Статья опубликована в рамках: VII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 04 июня 2012 г.)
Наука: Медицина
Секция: Клиническая иммунология, аллергология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ТЕРМИЧЕСКАЯ ТРАВМА АССОЦИИРОВАНА С УГНЕТЕНИЕМ РЕАКЦИИ НЕЙТРОФИЛОВ IN VITRO НА ГЛЮКОЗУ И ИНСУЛИН
Петракова Ольга Викторовна
канд. биол. наук, вед. науч. сотр., ЦНИЛ БГМУ, г. Минск
E-mail: petrakova@open.by
Гурманчук Ирина Евгеньевна
канд. мед. наук, доцент, вед. науч. сотр., ЦНИЛ БГМУ, г. Минск
Сыманович Ольга Юрьевна
мл. науч. сотр., ЦНИЛ БГМУ, г. Минск
Хватова Лилия Алекссевна
ст. науч. сотр., ЦНИЛ БГМУ, г. Минск
Маркевич Марина Николаевна
мл. науч. сотр., ЦНИЛ БГМУ, г. Минск
Уровень глюкозы в крови является одним из важных показателей, позволяющих оценить тяжесть состояния пациентов при ряде патологий [2]. Этот параметр, в том числе, коррелирует с выживаемостью больных и влияет на течение заболевания. Естественным, регулятором, обеспечивающим утилизацию глюкозы как энергетического субстрата, является инсулин. При этом рецепторы к инсулину присутствуют на поверхности большинства клеток. Этот гормон часто применяют в комплексной терапии ожоговой болезни. Его введение во многом обусловлено гипергликемией, развивающейся в ответ на повреждение (даже если в анамнезе не было сахарного диабета) [2, 3]. С учетом того, что иммунная система играет непосредственную роль в реализации воспалительного ответа, в том числе при термической травме, исследование действия высоких концентраций инсулина и глюкозы на функцию отдельных звеньев иммунитета представляется важным.
В исследование были включены пациенты (6 человек) с термическими травмами II-III-IV степени площадью 36,5 % ± 13,8. Средний возраст больных составил 47 ± 10,2 лет. Группу контроля составили 23 человека (средний возраст 37 ± 2,6 лет), не имеющих противопоказаний для донорства.
В работе была проведена оценка адгезивной [4] и метаболической [1] активности нейтрофилов периферической крови без воздействия (спонтанная активность) и под влиянием PМА (phorbol-12-myritat-13-acetate) и высоких концентраций инсулина и глюкозы. Конечная концентрация PМА (Sigma) составила – 10 нг/мл; инсулина (Invirtogen) – 10 , 50 и 100 нг/мл; глюкозы (Sigma) – 11 и 100 мМ. Для сравнения групп по количественному признаку использовали непараметрический критерий для независимых выборок Манна-Уитни и непараметрический критерий знаков для зависимых выборок. Отличия считали достоверными при р<0,05.
Анализ полученных данных позволил установить, что в группе доноров как инсулин (р=0,003), так и глюкоза (р=0,005) во всех использованных дозах приводили к достоверному росту адгезивной активности нейтрофилов периферической крови in vitro (рис. 1) по сравнению со спонтанной.

Рис. 1 – Влияние инсулина и глюкозы на адгезивную активность in vitro нейтрофилов периферической крови доноров
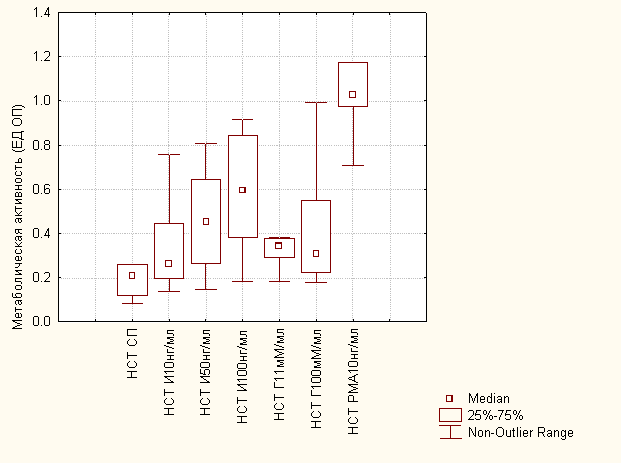
Рис. 2 – Влияние инсулина и глюкозы на метаболическую активность in vitro нейтрофилов периферической крови доноров
Аналогичные исследования были проведены нами в группе пациентов с тяжелыми термическими травмами. Результаты, полученные в этом эксперименте в значительной степени отличались от результатов, полученных в группе доноров. Так, при термической травме как инсулин, так и глюкоза в использованных концентрациях in vitro не оказывали достоверного влияния ни на адгезивную (рис. 3) ни на метаболическую (рис. 4) активность нейтрофилов крови (р<0,05).

Рис. 3 – Влияние инсулина и глюкозы in vitro на адгезивную активность нейтрофилов периферической крови пациентов с тяжелыми термическими травмами

Рис. 4 – Влияние инсулина и глюкозы in vitro на метаболическую активность нейтрофилов периферической крови пациентов с тяжелыми термическими травмами
В целом, у пациентов была выявлена тенденция к снижению адгезивных свойств клеток и некоторому увеличению их метаболической активности по сравнению со спонтанной при воздействии модуляторов, однако уровень значимости этих данных выше 0,05.
Наблюдаемое нами отсутствие реакции клеток пациентов на внесение инсулина и глюкозы может быть связано с характерным для большинства гормонов механизмом действия, а именно, с изменением после связывания с соответствующим лигандом конформации рецепторов с последующим объединением их в микроагрегаты и интернализацией для передачи сигнала. За счет этого процесса количество рецепторов на поверхности клетки уменьшается, и, следовательно, снижается чувствительность клеток и тканей к гормону. При термической травме для системного воспалительного ответа характерны эпизоды тяжелой гипергликемии и гиперинсулинемии, что, возможно, снижает способность клеток реагировать в полной мере на соответствующие воздействия.
Согласно полученным нами данным, которые также согласуются с результатами других исследователей [5, 6], рост адгезивной и метаболической активности в присутствии высоких доз инсулина и глюкозы в группе доноров является нормальной реакцией нейтрофилов, которая реализуется в том числе через активацию протеинкиназы С и МАР-киназ с последующей экспрессией на клетках ICAM-1. Проведенные нами исследования позволили выявить, что у пациентов с тяжелыми термическими травмами наблюдается дисрегуляция в функционировании клеток, а именно, снижение способности нейтрофилов периферической крови реагировать на метаболические регуляторы: глюкозу и инсулин в дозах, превышающих физиологические. По нашему мнению, степень проявления отрицательных реакций со стороны клеток иммунной системы под воздействием in vitro глюкозы и инсулина может стать критерием оценки ее функциональной состоятельности при принятии решения о назначении терапии, в том числе иммуномодулирующей в данной группе пациентов.
Список литературы:
1.Киселева Е.П., Полевщиков А.В. Метод автоматизированного учета НСТ-теста // Клиническая лабораторная диагностика. 1994. № 4. С. 27—29.
2.Holm C., Hörbrand F., Mayr M., von Donnersmarck G.H., Mühlbauer W. Acute hyperglycaemia following thermal injury: friend or foe? // Resuscitation. 2004. Vol. 60. P. 71—77.
3.Mann E.A., Mora A.G., Pidcoke H.F., Wolf S.E., Wade C.E. Glycemic control in the burn intensive care unit: focus on the role of anemia in glucose measurement // J Diabetes Sci Technol. Vol. 3. P. 1319—1329.
4.Nagano C., Azuma A., Ishiyama H. Rebamipide Suppresses Formyl—methionyl—leucyl—phenylalanine (fMLP)—Induced Superoxide Production by Inhibiting fMLP—Receptor Binding in Human Neutrophils // The Journal Of Pharmacology And Experimental Therapeutics. 2001. Vol. 297. No 1. Р. 388—394.
5.Okouchi M., Okayama N., Shimizu M., Omi H., Fukutomi T., Itoh M. High insulin exacerbates neutrophil—endothelial cell adhesion through endothelial surface expression of intercellular adhesion molecule—1 via activation of protein kinase C and mitogen— activated protein kinase // Diabetologia. 2002. Vol. 45, No 4. P. 556—559.
6.Walrand S., Guillet Ch., Boirie Y., Vasson M.—P. Insulin Differentially Regulates Monocyte and Polymorphonuclear Neutrophil Functions in Healthy Young and Elderly Humans // The Journal of Clinical Endocrinology & Metabolism. 2006. Vol. 91. No. 7. P. 2738—2748.
дипломов


Оставить комментарий