Статья опубликована в рамках: XXXVII Международной научно-практической конференции «Современная медицина: актуальные вопросы» (Россия, г. Новосибирск, 10 ноября 2014 г.)
Наука: Медицина
Секция: Ревматология
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
Выходные данные сборника:
РОЛЬ TH -17 КЛЕТОК В ПАТОГЕНЕЗЕ ЭНТЕЗИТ-АССОЦИИРОВАННОГО АРТРИТА И СИСТЕМНОГО ВАРИАНТА ЮИА
Турцевич Инга Зауровна
аспирант кафедры педиатрии имени профессора И.М. Воронцова ФП и ДПО, ГБОУ ВПО Санкт-Петербургского Государственного Педиатрического Медицинского Университета Минздрав РФ, РФ, г. Санкт-Петербург
E -mail: inga_turtsevich@mail.ru
Новик Геннадий Айзикович
д-р мед. наук, зав. Кафедрой педиатрии имени профессора И.М. Воронцова ФП и ДПО, профессор ГБОУ ВПО Санкт-Петербургского Государственного Педиатрического Медицинского Университета Минздрав РФ, РФ, г. Санкт-Петербург
THE ROLE OF TH-17 CELLS IN PATHOGENESIS OF ENTHESIS-RELATED ARTHRITIS AND SYSTEMIC ONSET OF JIA
Inga Turtsevich
PhD-student of department of pediatrics named by Professor I.M. Vorontsov State budget institution of higher professional education Saint-Petersburg State Pediatric
Medical University Ministry of Health of the Russian Federation, Russia, Saint-Petersburg
Gennadiy Novik
doctor of Medicine, Head of department of pediatrics named by Professor I.M. Vorontsov Professor of State budget institution of higher professional education Saint-Petersburg State Pediatric Medical University Ministry of Health of the Russian Federation, Russia, Saint-Petersburg
АННОТАЦИЯ
Основной целью исследования являлось установить особенности Th17 пути дифференцировки лимфоцитов у детей с различными вариантами ЮИА как механизма, определяющего характер клинического течения и исхода заболевания.
Уровень Th17 клеток и цитокинов ИЛ-1β, ИЛ-6, ИЛ-17А и ФНОα определялся в образцах периферической крови детей с ЮИА с использованием известных методов лабораторной диагностики.
Впервые было продемонстрировано, что наиболее высокий уровень Th17 клеток, ИЛ-17А, ИЛ-1β и ИЛ-6 был обнаружен у детей с энтезит-ассоциированным артритом (ЭАС) и системным артритом.
ABSTRACT
The aim of the current research was to set features of Th17 cells in children with juvenile idiopathic arthritis (JIA) as mechanism that determines the nature of clinical course and outcome of the disease.
Level of Th17 cells and cytokines, such as IL-1β, IL-6, IL-17A and TNFα were determined in PB samples in children with different subtypes of JIA, using well-known methods of laboratory diagnostics.
For the first time it was described that highest level of Th17 cells, IL-17A IL-1β and IL-6 in PB were found in children with «active» enthesitis-related (ERA) and systemic arthritis.
Ключевые слова: ювенильный идиопатический артрит; ЮИА; артрит; Th17 клетки; ИЛ-1β; ИЛ-6; ИЛ-17А; ФНОα; цитокины; энтезит-ассоциированный артрит; ЭАС; HLA B27; системный артрит.
Keywords: juvenile idiopathic arthritis; JIA; arthritis; Th17 cells; IL-1β; IL-6; IL-17A; TNFα; cytokines; enthesitis-related arthritis; ERA; HLA B27; systemic arthritis.
Согласно современным представлениям, ювенильный идиопатический артрит (ЮИА) остается одной из наиболее распространённых заболеваний детского возраста, в структуру которого входят все формы артрита, и характеризуется как хроническое воспалительное заболевание суставов неизвестной этиологии, которое начинается до 16-ти летнего возраста, длительностью более 6 недель, при исключении другой патологии суставов. ЮИА является по своей природе аутоиммунным заболеванием, патогенез которого глубоко уходит своими корнями в нарушение регуляции механизмов, посредством которых Т-клетки способны различать «свое» от «чужеродного» [1, с. 18; 6, с. 88].
Антигенная стимуляция наивных CD4+Т клеток в присутствии специфических цитокинов, продуцируемых клетками первичной иммунной системы, индуцируют активацию, экспансию и дифференцировку в различные эффекторные Тh клетки (Th1/Th2 лимфоциты). Выделение новой субпопуляции Th лимфоцитов — Th17 клеток в 2005 году (Harrington, Langrish, Park и соавт.) расширило знание о патогенезе многих воспалительных и инфекционных заболеваний [2, с. 25; 5, с. 1012]. В течение последних лет Тh17 клетки подверглись интенсивному изучению, в результате которого удалось показать источники происхождения, пути дифференцировки и часть функциональных особенностей. E.V. Acosta-Rodriguez и соавт. (2007), исследовав процесс дифференцировки Th17 клеток в образцах крови человека in vitro выявили, что активированные моноциты и циркулирующие дендритные клетки, продуцирующие большое количество ИЛ-1β и ИЛ-6, достаточны для дифференцировки Th17 клеток [3, с. 947]. Исследователями также была проанализирована субпопуляция Th17 клеток с целью доказать их отличие от Th1 и Th2 клеток, а также от других клеток иммунной системы. В качестве молекул, идентифицирующих эти клетки, были выбраны мембранные хемокиновые рецепторы, которые являются инструментом для характеристики Тh-клеток, так как позволяют с большой долей вероятности отличить один тип Тh от другого. Таким образом, было выявлено, что экспрессия CCR6 и СCR4 идентифицируют у человека гомогенную популяцию Тh клеток, которая продуцирует ИЛ-17. При этом CCR6 является более специфичным хемокиновым рецептором, так как экспрессируется только на поверхности Th17 клеток, в то время как CCR4 представлен и на Th1 лимфоцитах [4, с. 645].
ИЛ-17 был идентифицирован в 1993 году P. Rouvier и соавт., задолго до открытия непосредственно Th17 клеток, и первоначально назывался CTLA-8 (cytotoxic T lymphocyte associated antigen 8). Семейство цитокинов ИЛ-17 включает в себя 6 членов, включая ИЛ-17А, ИЛ-17В, ИЛ-17С, ИЛ-17D, ИЛ-17Е (или ИЛ-25) и ИЛ-17F. Различные члены семейства ИЛ-17, вероятно играют разнообразную биологическую роль, однако Th17 клетки продуцируют лишь 2 представителя этого семейства — ИЛ-17А и ИЛ-17F, но биологически более эффективным является ИЛ-17А. После многочисленных экспериментов стало очевидно, что Th17 клетки и их цитокины ассоциированы с различными аутоиммунными и воспалительными заболеваниями, такими как ревматоидный артрит, ЮИА, системная красная волчанка, рассеянный склероз, псориаз, воспалительные заболевания кишечника, аллергия (ГЗТ, контактный дерматит) и неатопическая астма [7, с. 648].
ИЛ-17A в значительных количествах присутствует в воспалённом синовиуме и в небольших количествах в периферической крови пациентов с РА. K. Nistala и соавт. (2008) обнаружили высокий уровень Th17 и ИЛ-17А в суставах детей с ЮИА, в частности, при прогрессирующем олигоартикулярном варианте заболевания. При этом Тh17 клетки были равномерно распределены в популяции Т-хелперов (CD4+) и Тh клеток-памяти [6, с. 157].
ИЛ-17А индуцирует экспрессию RANKL синовиальными фибробластами и остеобластами, приводя к секреции остеокластогенных факторов, таких как ФНОα и ИЛ-1β. Эта Th17-опосредованная индукция остеокластогенеза может представлять важный клеточный механизм в патогенезе костно-хрящевой деструкции при аутоиммунном артрите [8, с. 706].
Роль Th17 клеток и ИЛ-17А в развитии ЮИА не до конца изучена. Так, остается неясным влияние Th17 клеток на течение и исход заболевания у детей при различных вариантах течения ЮИА, а также способны ли современные ГИБП, применяемые у детей, ингибировать дифференцировку Th17 клеток из наивных Тh клеток.
Методы исследования: Количественное определение лимфоцитов и их субпопуляций в условиях in vitro осуществлялось методом непрямой иммунофлюоресценции с помощью проточной цитометрии с использованием моноклональных антител к их поверхностным антигенам (СD). Таким образом, всем пациентам с ЮИА и группе сравнения было проведено иммунологическое исследование, включавшее определение общего количества CD4+ (мономерный трансмембранный гликопротеин, экспрессирующийся на Т-хелперах) клеток, определение дифференцировочного антигена CD45 с изоформами RА, которая является маркером наивных Тh клеток (CD4+CD45+RO-RA+) и RO, которая экспрессируется на Тh клетках-памяти (CD4+CD45+RO+RA-) и «переходную» форму Тh клеток, несущая обе изоформы — дубль-позитивные Тh клетки (CD4+CD45+RO+RA+) (все реактивы Beckman coulter, Immunotech, France). Для определения уровня Th17 клеток был измерен мембранный хемокиновый рецептор CCR6 (CD196, Clon:R6H1, eBioscience, San Diego, CA, USA), который является маркером этих клеток и характеризует их субпопуляционный состав - наивных Th17 клеток (CCR6+RA) и Th17 клеток-памяти (CCR6+RO).
Количественное определение цитокинов ИЛ-1β, ИЛ-6, ИЛ-17 и ФНОα в сыворотке крови больных ЮИА и группы сравнения определяли с помощью иммуноферментного анализа (ИФА-ELISA) с применением набора реагентов для ИЛ-1β, ИЛ-6 и ФНОα фирмы ЗАО «Вектор-Бест» (г. Новосибирск), для ИЛ-17A — eBioscience (San Diego, CA, USA).
Статистическая обработка результатов исследования осуществлялась с использованием пакетов SPSS IBM версия 21.0 и Statistica 10.
Результаты исследования: В исследование было включено 108 детей с различными вариантами ЮИА в возрасте от 2 до 18 лет (средний возраст 10,5±3,8 лет), которые полностью соответствовали критериям ILAR (Durban, Edmonton, 2001, second revision 2004). В зависимости от варианта течения все дети были разделены на 4 группы: дети с олигоартритом — 32 пациента (29,6 %); дети с полиартритом, серонегативного по РФ — 30 пациентов (27,8 %); группа с энтезит-ассоциированным артритом (ЭАС) — 33 ребёнка (30,6 %) с HLA B27+ ювенильным анкилозирующим спондилоартритом (ЮАС); и группа с системным вариантом течения ЮИА составила 13 детей (12 %).
В зависимости от эффективности проводимой терапии дети были разделены на две подгруппы: дети с «активной» болезнью и дети с «неактивной» болезнью. «Активная» болезнь определялась, как наличие одного или более суставов с признаками воспаления, болезненности и ограничения функций на фоне проводимого лечения. «Неактивная» болезнь определялась как отсутствие всех клинико-лабораторных признаков суставного воспаления и увеита в течение минимум 1 года на фоне базисной терапии, совпадающие с нулевой активностью визуально-аналоговой шкалы (ВАШ).
Группу сравнения составили 18 условно-здоровых детей с неотягощенной наследственностью по аутоиммунным заболеваниям.
Для оценки активности заболевания и эффективности терапии применялись шкалы ACRpedi и JADAS71CRP, специально разработанные для использования в педиатрической ревматологической практике.
Сравнительная оценка общей популяции CD4+ Т клеток не выявила различий между пациентами с ЮИА и группой сравнения (р=0,4), уровень этих клеток был в пределах допустимых значений. В группе детей с «активной» и «неактивной» болезнью статистически значимых различий уровня общей популяции CD4+ Т клеток не выявлено (р˃0,05).
Наиболее высокий уровень наивных Тh клеток (CD45+RA) и наиболее низкий уровень Тh клеток-памяти (CD45+RO) наблюдался у детей с олиго- и полиартритом (р=0,022, р=0,005, соответственно) как в «активной», так и «неактивной» болезни. При ЭАС и системном варианте ЮИА статистически значимых различий выявлено не было (р˃0,05).
Уровень дубль-позитивных Тh клеток (CD45+RO+RA+) в периферической крови не отличался у детей с различными вариантами течения ЮИА как при «активной», так и «неактивной» болезни (р˃0,05).
Сравнительная оценка уровня маркера Th17 клеток на наивных Тh клетках (CCR6+RA) не выявила статистически значимых отличий между детьми с ЮИА и группой сравнения (р˃0,05).
Статистически значимые отличия отмечались в уровне Th17 клеток-памяти (CCR6+RO) при всех вариантах течения ЮИА в сопоставлении с группой сравнения (р=0,001). Наиболее высокий уровень этих клеток в периферической крови был обнаружен у детей с «активным» ЭАС (р=0,001) и системным вариантом артрита (р=0,002) (таблица 1).
Таблица 1.
Средний уровень Th 17 клеток-памяти у детей с ЮИА и группы сравнения
|
Вариант течения |
|
N |
M |
SD |
Sx |
Me (LQ-UQ) |
p * |
|
Олигоартрит |
Активный |
23 |
2,2 |
1,1 |
0,33 |
2,8 (2,4-3,8) |
0,243 |
|
Неактивный |
9 |
2,4 |
0,4 |
0,13 |
2,7 (2,4-3,1) |
||
|
Полиартрит |
Активный |
26 |
2,4 |
1,8 |
0,4 |
3,1 (2,3-3,7) |
0,6 |
|
Неактивный |
4 |
2,2 |
0,7 |
0,4 |
2,1 (0,8-3,0) |
||
|
ЭАС** |
Активный |
26 |
5,3 |
2,3 |
0,5 |
5,1 (4,3-6,2) |
0,024 |
|
Неактивный |
7 |
3,0 |
2,1 |
0,8 |
2,6 (1,1-4,9) |
||
|
Системный вариант |
Активный |
13 |
3,8 |
2,4 |
0,7 |
2,9 (2,3-5,1) |
0,002*** |
|
Группа сравнения |
- |
18 |
1,1 |
0,4 |
0,1 |
1,2 (0,9-1,3) |
0,001*** |
* — U тест Манна-Уитни, ** — Энтезит-ассоциированный артрит (HLA B27+ ЮАС), *** — при сравнении с другими вариантами течения ЮИА
Уровень ИЛ-1β в сыворотке крови у детей с ЮИА как в «активной» так и «неактивной» болезни статистически достоверно был выше, чем в группе сравнения (р=0,038). Особенно высокий уровень ИЛ-1β отмечался у больных с «активным» ЭАС (р=0,007). Статистически значимых различий уровня ИЛ-1β между «активным» и «неактивным» артритом при всех вариантах течения ЮИА не отмечалось (р˃0,05).
При оценке гендерных различий была выявлена статистическая достоверность в группе с «активным» ЭАС. Так, уровень ИЛ-1β в сыворотке крови у мальчиков «активным» энтезит-ассоциированным артритом значительно превышал уровень данного цитокина у девочек (22,9±8,4 пг/мл и 11,4±6,9 пг/мл, соответственно, при р<0,05).
Уровень ИЛ-6 в сыворотке крови у детей с ЮИА был статистически достоверно выше, чем в группе сравнения (р=0,005). Наиболее высокий уровень ИЛ-6 отмечался у пациентов с системным вариантом артрита (р=0,028) и в группе детей с ЭАС (р=0,048).
Сравнительная оценка уровня ИЛ-17А в сыворотке крови выявила статистически значимые различия между детьми с ЮИА и группой сравнения (р=0,001). Наиболее высокий уровень ИЛ-17А отмечался у детей с «активным» ЭАС (р=0,001) и системным вариантом течения ЮИА (р=0,006).
Уровень ФНОα в сыворотке крови был достоверное выше в группе детей с ЮИА, независимо от варианта течения (р=0,005). Статистически значимых межгрупповых и внутригрупповых различий у детей с ЮИА обнаружено не было (р˃0,05) (рисунок 1).
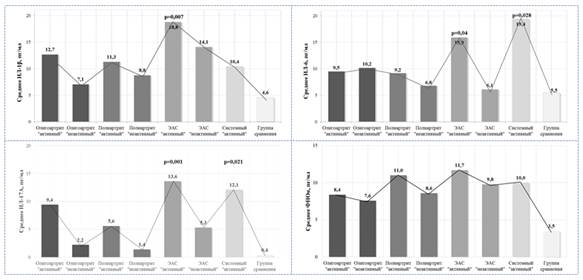
Рисунок 1. Уровень провоспалительных цитокинов в зависимости от варианта течения ЮИА. ЭАС — энтезит-ассоциированный артрит (HLA B27+ ЮАС)
Сравнительная оценка общего количества CD4+ Т клеток и их субпопуляций в периферической крови выявила положительную корреляцию между общей популяцией Т-хелперов с наивными Тh клетками (CD45+RA) (коэффициент Пирсона = 0,32, р=0,008) и отрицательную корреляцию с Тh клетками-памяти (CD45+RO) (коэффициент Пирсона = -0,25, р=0,026). Уровень CD45+RO негативно коррелировал с уровнем CD45+RA (коэффициент Пирсона = -0,85, p=0,001), а уровень CD45+RA отрицательно коррелировал с дубль-позитивными Тh клетками (CD45+RO+RA+) (коэффициент Пирсона = -0,517, р=0,001).
С помощью метода линейной корреляции и построением уравнения множественной регрессии была оценена степень влияния Th17 клеток и исследуемых провоспалительных цитокинов на основные клинико-лабораторные показатели, где р<0,05 считался статистически достоверным.
Как у мальчиков, так и у девочек выявлена отрицательная корреляция Th17 клеток-памяти (CCR6+RO) с наивными Тh клетками (CD45+RA) (корреляция Пирсона = -0,384, р=0,001) и положительная корреляция CCR6+RO с общим уровнем Тh клеток-памяти (CD45+RO) (корреляция Пирсона = 0,250, р=0,005) и дубль-позитивными Th клетками (CD45+RO+RA+) (корреляция Пирсона = 0,372, р=0,001). Выявлена положительная корреляция CCR6+RO с провоспалительными цитокинами ИЛ-17А (корреляция Пирсона = 0,446, р=0,001), ИЛ-1β (корреляция Пирсона = 0,263, р=0,003) и ИЛ-6 (корреляция Пирсона = 0,230, р=0,01).
При дальнейшей оценке корреляционных взаимосвязей была выявлена сильная положительная корреляция ИЛ-1β с ИЛ-6 (корреляция Пирсона = 0,388, р=0,001) и слабая положительная корреляция ИЛ-1β с ФНОα (корреляция Пирсона = 0,341, р=0,001), а также ИЛ-6 с ИЛ-17А (корреляция Пирсона = 0,242, р=0,006) у детей с ЭАС и системным вариантом ЮИА.
У детей с ЮИА, вне зависимости от пола, проведенный регрессионный анализ выявил сопряженность активности заболевания с уровнем ИЛ-17А, как перехода заболевания из «неактивной» в «активную» болезнь (p=0,012). При оценке влияния изучаемых показателей на варианты течения ЮИА, была выявлена статистически достоверная взаимосвязь CCR6+RO и ИЛ-17А с ЭАС, вне зависимости от «активной» или «неактивной» болезни (p=0,001; p=0,005, соответственно).
Заключение
В нашем исследовании мы обнаружили, что те пациенты, у которых был высокий уровень Th17 клеток в крови, также имели и высокую концентрацию ИЛ-1β, ИЛ-6 и ИЛ-17А. Исходя из полученных результатов, можно предположить, что высокие уровни этих цитокинов в сыворотке крови у пациентов с ЭАС и системным артритом могут быть связаны с активностью у них Th17 клеток. Это объясняется результатами многочисленных исследований, в которых была доказана ключевая роль ИЛ-1β и ИЛ-6 в дифференцировке Th17 клеток, которые в свою очередь вырабатывают большое количество ИЛ-17А, а также способны активировать продукцию ИЛ-1β, ИЛ-6 и ИЛ-17А другими клетками иммунной системы, замыкая, тем самым порочный круг [3, c. 943].
Полученные в ходе исследования данные позволяют нам подтвердить важность Th17 клеток в патогенезе ЮИА, и ведущее значение данного пула клеток в формировании HLA B27-ассоциированного артрита и системного варианта ЮИА.
Список литературы:
1.Алексеева Е.И., Литвицкий П.Ф. Ювенильный ревматоидный артрит: этиология, патогенез, клиника, алгоритмы диагностики и лечения. Москва: ВЕДИ, 2007. — 368 с. (1).
2.Кетлинский С.А. Th17 — новая линия дифференцировки Т-хелперов: обзор данных // Журнал «Цитокины и воспаление». — 2009. — Том 8. — № 2. — С. 24—39 (6).
3.Acosta-Rodriguez E.V, Napolitani G., Lanzavecchia A., Sallusto F. Interleukins 1β and 6 but not transforming growth factor — β are essential for the differentiation оf interleukin 17 – producing human T helper cells. // Nature immunology. 2007; 8(9): 942—49.
4.Acosta-Rodriguez E.V, Rivino L., Geginat J., Jarrossay D., Gattorno M., Lanzavecchia A., Sallusto F., Napolitani G. Surface phenotype and antigenic specificity of human interleukin 17–producing T helper memory cells. // Nature Immunology. 2007; 8(9): 639—46.
5.Almanzar G., Zlamy M., Koppelstaetter C., Brunner A., Jeller V, Duftner Ch., Dejaco C., Brunner J., Prelog M. Increased replication of CD4+ naive T cells and changes in T cell homeostasis in a case of acute exacerbation of juvenile idiopathic arthritis: a case comparison study. // Journal of Medical Case Reports 2013; 7(135): 1011-19.
6.Cassidy J., Petty R., et al. Textbook of pediatric rheumatology, 6th Revised edition. // Elsevier — Health Sciences Division, 2010. — 800 c. (4).
7.Kurebayashi Y., Nagai S., Ikejiri A. and Koyasu S. Recent advances in understanding the molecular mechanisms of the development and function of Th17 cells. // Genes to Cells. 2013; 18(4): 247-65. (5).
8.Weitzmann M.N. The Role of Inflammatory Cytokines, the RANKL/OPG Axis, and the Immunoskeletal Interface in Physiological Bone Turnover and Osteoporosis. // Scientifica (Cairo). 2013; 2013: 705-11.
дипломов


Оставить комментарий