Статья опубликована в рамках: II Международной научно-практической конференции «Научные достижения биологии, химии, физики» (Россия, г. Новосибирск, 30 ноября 2011 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
Статья опубликована в рамках:
НЕЭМПИРИЧЕСКОЕ ИССЛЕДОВАНИЕ ЕНОЛИЗАЦИИ ИМИНОАЦЕТИЛАЦЕТОНА И ЕГО ХЛОРЗАМЕЩЕННОГО
Иванов Юрий Васильевич
к. х. н., доцент ДВГТРУ, г. Владивосток
E-mail: iyuv@rambler.ru
Одной из характерных особенностей 1,3-дикарбонильных соединений является их способность к кето-енольной таутомерии с образованием в енольной форме сопряженной π-системы. Кето-енольная таутомерия в химии дикетонов не только представляют большой теоретический интерес, но и имеет непосредственное практическое значение, что на протяжении длительного времени привлекает внимание исследователей [1, 2].
Имино-производные 1,3-дикарбонильных соединений также представляют значительный интерес, как объекты в самых различных областях химии, в частности в качестве лигандов для синтеза комплексных соединений. Однако енамино-иминная таутомерия водородной связи исследовалась в меньшей степени чем кето-енольная [3].
Целью настоящей работы было исследование неэмпирическими квантовохимическими методами энергетики таутомерии 1,3-енаминокетонов, влияния хлорзамещения в β-положении на энтальпию таутомеризации, а также возможности применения различных базисных наборов для объектов такого типа:
Расчеты выполнялись с использованием неэмпирической программы MPQC [4] с полной оптимизацией геометрических параметров ограниченным методом Хартри-Фока в валентно-расщепленных дубль- и трипл-дзета базисах с добавлением диффузионных и поляризационных функций RHF/STO 6-31++G** и RHF/STO 6-311++G(3df,3pd), а также с учетом корреляционных поправок по методу возмущения Меллера-Плессета второго порядка MP2/STO 6-31++G**.
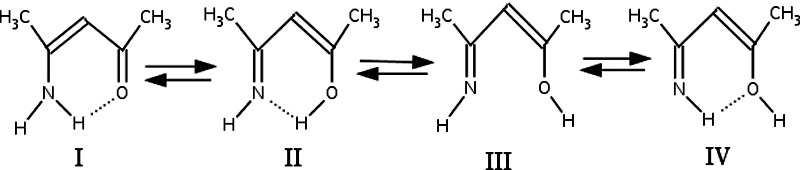
Особенностью таутомерии енаминокетонов является то, что во всех енольных формах I‑IV присутствует π-сопряженная система, а водородная связь может быть образована за счет различной конфигурации связей при атоме азота и кислорода, что будет вносить определяющий вклад в энергетику енолизации. Однако енолизация может происходить не только по карбонильному кислороду (структуры II, IV), но также и по азоту (структура I), а в енолизованной по карбонильному кислороду форме могут образовываться водородные связи различной природы: H...O, как в структуре IV, и H...N в структуре II. Эти факторы увеличивает число возможных таутомерных форм для производных декетонов.
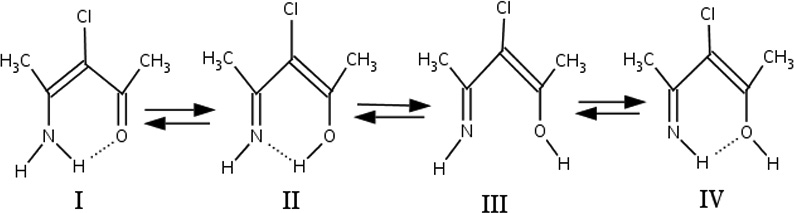
Таутомерные формы β-хлориминокетонов могут представлять интерес как объекты, в которых присутствует дополнительный фактор электроноакцепторного заместителя, имеющего положительный мезомерный эффект и включенный тем самым в сопряжение системы за счет занятых p-AO Cl.
Сравнительный анализ расчетов энергии таутомера III, не имеющего водородной связи, выполненных различными методами (табл. 1), показывает, что основная поправка к полной энергии системы (более 1 а.е.) появляется не за счет расширения базиса, а в результате учета корреляционных эффектов. Аналогичная картина наблюдается и для остальных таутомерных форм. Дальнейшее расширение базиса нельзя признать целесообразным, так как затраты машинного времени в этом случае резко возрастают, тогда как точность расчетов увеличивается незначительно. В тоже время учет корреляционной энергии в рамках теории возмущений Метллера-Плессета второго порядка позволяет достичь лучших результатов при разумных затратах вычислительных ресурсов.
Таблица 1.
Относительная энергия (ΔE, а.е.) енолизованой формы без водородной связи (III)
|
Базис |
6-31++G** |
6-311++G(3df,3pd) |
MP2/6-31++G** |
|
Иминокетон |
0 |
-0,0940 |
-1,0819 |
|
Хлориминокетон |
0 |
-0,1254 |
-1,2234 |
К наибольшему энергетическому выигрышу, как следует из расчетов (табл.2) приводит енолизация по атому азота, что обуславливается как образованием достаточно прочной водородной связи H…O, так и появлением спряженной системы C=C-C=O, и образованием более устойчивой sp3-конфигурации атома азота. В то же время, если сравнить энергию структуры IV, то можно заметить, что энергия водородной связи (оцененная как разность между III и IV), составляет около 8 кДж/моль для незамещенного иминокетона. И таким образом, Основной выигрыш достигается за счет образования енамино-кетонной сопряженной системы и изменения характера связей у атома азота (~34 кДж.моль). Интересно отметить, что расчет в более грубом базисе более приближен к расчету с учетом энергии корреляции.
Таблица 2.
Энергия таутомеров иминокетона (кДж/моль)
|
Базис |
I |
II |
III |
IV |
|
6-31++G** |
-52,82 |
-34,57 |
0 |
-8,82 |
|
6-311++G(3df,3pd) |
-49,24 |
-31,40 |
0 |
-6,99 |
|
MP2/6-31++G** |
-50,23 |
-36,82 |
0 |
-8,66 |
Введение атома хлора в β-положение в целом, как можно видеть из табл.3, незначительно уменьшает разность энергии таутомеров. Это понижение приводит к тому, что энергия образования водородной связи O…H у таутомера IV практически нивелируется, сравниваясь с энергией теплового барьера.
Энергия водородной связи N…H в таутомере II также понижается при введении атома хлора на ~4 кДж/моль, хотя и остается значительно прочнее связи O…H, так же, как и для случая незамещенного иминоенола.
Образование хлоренаминокетона также является наиболее выгодным процессом с точки зрения энергетики реакции енолизации, а разница с незамещенным енаминокетоном в полной энергии еще меньше, чем для других таутомеров и составляет ~3 кДж/моль.
Таблица 3.
Энергия таутомеров хлориминокетона (кДж/моль)
|
Базис |
I |
II |
III |
IV |
|
6-31++G** |
-50,01 |
-29,86 |
0 |
-1,41 |
|
6-311++G(3df,3pd) |
-46,87 |
-27,28 |
0 |
-0,12 |
|
MP2/6-31++G** |
-47,36 |
-32,44 |
0 |
-5,00 |
Общее незначительное понижение энергии образования хлорзамещенных енолов и енаминов может быть связано с электроноакцепторным влиянием атома хлора, который оттягивая электронную плотность ослабляет как связи кглеродного скелета, так и водородные связи в системе.
Согласно расчетам, все структуры имеют наиболее выгодное плоское геометрическое строение. Это ожидаемый результат для таутомеров I, II и IV, имеющих водородную связь в рамках шестичленного цикла с π-сопряжением. Однако и структура III, как показывают расчеты, также является плоской. Единственный случай, когда расчет явно указывал на предпочтительность неплоской структуры III, был расчет с учетом корреляционных поправок Меллера-Плессета. В Случае хлорзамещенного угол выхода азота из плоскости C-C-O составлял ~30о. Однако этот эффект также можно объяснить стерическими факторами, связанными с введением достаточно объемного атома хлора. В остальных случаях, энергия сопряжения системы, по-видимому, как показывали расчеты, достаточно существенна, чтобы перекрыть интрамолекулярное отталкивание атомов O и N. Во всех случаях, методы расчета практически не сказывались на таких геометрических параметрах, как длины валентных связей и валентные углы.
Список литературы:
1. К. И. Пашкевич, В. И. Салоутин, И. Я. Постовский. Фторсодержащие
β-дикетоны. Успехи химии, 1981, 50, № 2, с. 325‑354.
2. A. Cook (ed), Enamines: synthesis, structure and reactions, New York: Marcell Decker, 1969.
3. S. Lu, A. Lewin, Enamine-imine tautomerism in unsaturated amino acids, Tetrahedron, 1998, 54, p. 15097-15014.
4. The Massively Parallel Quantum Chemistry Program (MPQC), Version 2.3.1, Curtis L. Janssen, Ida B. Nielsen, Matt L. Leininger, Edward F. Valeev, j25eph P. Kenny, Edward T. Seidl, Sandia National Laboratories, Livermore, CA, USA, 2008.
дипломов

Оставить комментарий