Статья опубликована в рамках: VIII Международной научно-практической конференции «Естественные и математические науки в современном мире» (Россия, г. Новосибирск, 22 июля 2013 г.)
Наука: Химия
Секция: Неорганическая химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
ИСПОЛЬЗОВАНИЕ ДОНОРНО-АКЦЕПТОРНЫХ СИСТЕМ ДЛЯ ИЗВЛЕЧЕНИЯ МЕТАЛЛОВ ИЗ ТЕХНОГЕННЫХ ОТХОДОВ
Хентов Виктор Яковлевич
профессор, д-р хим. наук, Южно-Российский государственный технический университет, г. Новочеркасск
E-mail: vkhentov@mail.ru
Сёмченко Владимир Владимирович
доцент, канд. хим. наук, Южно-Российский государственный технический университет, г. Новочеркасск
Хуссейн Ханаа Хассан
аспирант, Южно-Российский государственный технический университет, г. Новочеркасск
THE USE OF DONOR-ACCEPTOR SYSTEMS FOR THE EXTRACTION OF METALS FROM INDUSTRIAL WASTE
Khentov Viktor
doctor of Chemistry, Professor of South-Russian State Technical University, Novocherkassk
Semchenko Vladimir
candidate of Science, assistant professor of South-Russian State Technical University, Novocherkassk
Hussain Hanaa
postgraduate, South-Russian State Technical University, Novocherkassk
АНОТАЦИЯ
Реакционная способность донорно-акцепторных систем использована для извлечения переходных металлов из техногенных отходов и бедного рудного сырья. Важная роль в донорно-акцепторном взаимодействии отводится неводным растворителям.
ABSTRACT
The reactivity of the donor-acceptor systems used to extract transition metals from industrial waste and poor ore. Important role in the donor-acceptor interaction is given a non-aqueous solvents.
Ключевые слова:донорно-акцепторные системы; неводные растворители; структурные параметры твердого тела; мицеллярный катализ; критическая концентрация мицеллообразования.
Keywords: donor-acceptor system; non-aqueous solvents; solid structural parameters; micellar catalysis; critical micelle concentration.
Накопление техногенных отходов достигло гигантских размеров. Они занимают огромные площади. Это отвалы горнодобывающей промышленности; отходы абразивной обработки металлов; пылевые выбросы промышленных предприятий, содержащих значительные количества ценных металлических элементов и их химических соединений; отходы выработавших свой ресурс катализаторов промышленности органического синтеза. Важно заметить, что в техногенных отходах содержатся в значительных количествах металлические элементы, как в виде нуль-валентных металлов, так и их соединений с ковалентными связями. Геологи называют техногенные отходы техногенными залежами. Существующие сегодня гидрометаллургические методы исчерпали свои возможности, в особенности для переработки бедного рудного сырья.
Для исследования выбраны d-элементы и их соединения, содержащиеся в техногенных отходах. По химическому составу — это металлы и малорастворимые в воде их соединения (оксиды, сульфиды, карбонаты, фосфаты).
Обработку металлов в виде пластины размером 30×20×1 мм с общей площадью поверхности 13 см2 (рассчитана как сумма площадей всех граней прямоугольного параллелепипеда) и дисперсных частиц, а также и их соединений проводили в растворах лиганда объемом 60 мл при работающей пропеллерной мешалке (200 об·мин-1). В качестве растворителя использовали N,N-диметилформамид. Для определения эффективной площади поверхности дисперсных частиц с помощью измерительного микроскопа проводили измерение их размеров, строили гистограмму и находили наивероятнейшее значение эффективного диаметра частицы. Это позволило вычислить удельную площадь поверхности порошка и рассчитать суммарную площадь порошка каждой навески. Скорость химической реакции (моль·см-2·ч-1) рассчитывали с учетом суммарной поверхности компактного или порошкообразного образца.
Определение концентрации раствора полученного комплексного соединения проводили по оптической плотности раствора. Предварительно строили калибровочные зависимости оптической плотности от концентрации комплексного соединения. Для этого синтезировали комплексные соединения по классическим методикам. Для идентификации комплексных соединений, полученных по классическим методикам и в настоящей работе, снимали ИК-спектры в интервале частот 3700—400 см-1. Одновременно определяли потерю массы исследуемых образцов.
Металлы реагируют с растворами лиганда в апротонном растворителе только при доступе кислорода воздуха, в атмосфере азота химическое взаимодействие прекращается.
Вначале было обнаружено, что высокодисперсная и компактная медь самопроизвольно и эффективно взаимодействует с салицилальанилином (2‑окси-1-бензилиденанилином) в неводных растворителях [3]. Затем экспериментально было установлено донорно-акцепторное взаимодействие меди, никеля и их труднорастворимых соединений (соединений с ковалентными связями) с салицилальанилином в диметилформамиде [5]. Реакция протекала без специально введенного в донорно-акцепторную систему окислителя. Было установлено, что роль окислителя играет растворенный в неводном растворителе кислород.
Значительная роль в донорно-акцепторном взаимодействии отводится неводному растворителю. Экспериментально установлена тесная связь константы скорости донорно-акцепторного взаимодействия меди с салицилальанилином k и параметра полярности растворителя Димрота-Райхардта ЕТ [3]:
ln k = aET + b,
где: a и b — эмпирические коэффициенты.
Выделяются зависимости для растворителей, содержащих кислород и растворителей, не содержащих кислород (табл. 1). Аналогичные зависимости найдены и для других металлов.
Таблица 1.
Корреляционные зависимости lg k = f(ЕТ), коэффициент корреляции R
|
Зависимости lgk= f(ЕТ) |
R |
Примечания |
|
lgk= ‒10,274 + 0,191ЕТ |
0,897 |
Для всех растворителей |
|
lg k = ‒14,433+0,313ЕТ |
0,983 |
Растворители, не содержащие кислород |
|
lg k = ‒10,493 +0,187ЕТ |
0,966 |
Растворители, содержащие кислород |
Можно утверждать, что реакционная способность лиганда в полярных растворителях заметно возрастает. Электрофильность растворителя играет важнейшую роль.
Эффективно происходит взаимодействие ковалентных соединений меди и других переходных металлов с лигандом салицилальанилином, растворенным в диметилформамиде (табл. 2) [6].
Таблица 2.
Скорость взаимодействия V, энергия активации Еа
|
Соединение |
V·106, моль/(см2∙ч) |
Еа, кДж/моль |
|
CuO |
0,50 |
71,0 |
|
Cu(OH)2 |
14,85 |
19,5 |
|
(CuOH)2CO3 |
18,80 |
43,3 |
|
CuS |
1,29 |
38,9 |
Также эффективно удается извлекать переходные металлы из рудного сырья (табл. 3) [1, 6, 7].
Таблица 3.
Скорость извлечения металла V (моль/г·ч), энергия активации Ea (кДж/моль), степень извлечения α (%)
|
Рудное сырье |
Формула |
V·105 |
Ea |
α |
|
Халькопирит |
CuFeS2 |
64,00 |
53±2 |
37,61 |
|
Халькозин |
Cu2S |
148,00 |
18,3±1 |
81,39 |
|
Ковеллин |
CuS |
76,00 |
38,9±2 |
85,60 |
|
Борнит |
Cu5FeS4 |
22,00 |
117±3 |
47,60 |
|
Куприт |
Cu2O |
19,00 |
36±1 |
63,33 |
|
Тенорит |
CuO |
59,00 |
68±2 |
70,60 |
|
Малахит |
(CuOH)2CO3 |
24,00 |
43±4 |
79,89 |
|
Шпинель |
CuFe2O4 |
3,33 |
171±3 |
72,47 |
|
Гематит |
Fe2O3 |
3,75 |
98±2 |
76,70 |
|
Магнетит |
Fe3O4 |
0,13 |
87±3 |
69,59 |
|
Сидерит |
FeCO3 |
1,50 |
69±2 |
72,34 |
|
Ванадит |
Pb5(VO4)3Cl |
58,00 |
45±4 |
50,71 |
|
Аргентит |
Ag2S |
183,00 |
- |
76,00 |
Повышенный интерес вызывает использование смешанных растворителей, особенно, продуцирующих протоны. Зависимость скорости V взаимодействия компактной меди с 0,01 М раствором салицилальанилина в диметилформамиде в функции концентрации воды С ярко демонстрирует рис. 1. Эти зависимости связаны с изменением сольватации лиганда в смешанном растворителе.
Существует еще один эффективный прием повышения скорости донорно-акцепторного процесса. В последнее время повышенное внимание уделяется микрогетерогенным организованным средам на основе поверхностно-активных веществ (ПАВ) [2]. Это среды, в которых при определенных концентрациях ПАВ происходит образование мицелл.
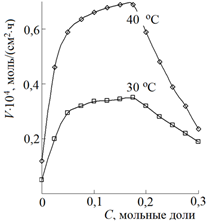
Рисунок 1. Скорость донорно-акцепторного взаимодействия в функции концентрации воды
Появление в воде мицелл ПАВ позволяет организовать процесс мицеллярного катализа. Это становится возможным при концентрациях превышающих критическую концентрацию мицеллообразования (ККМ). В неводных средах значение ККМ возрастают на несколько порядков. В качестве ПАВ использовался неионогенный оксиэтилированный изооктилфенол RC6H4O(CH2CH2O)nH, где n = 7 (число присоединенных молей оксида этилена); R-гидрофобный углеводородный радикал С6-С10. Измерение поверхностного натяжения и вязкости при введении указанного ПАВ в диметилформамид при температуре 20 оС позволило найти ККМ (~15 %). Повышение температуры привело к снижению ККМ. В такой организованной среде, содержащей в качестве лиганда салицилальанилин (0,1 моль/л), установлено увеличение в три раза скорости донорно-акцепторного взаимодействия. Это свидетельствует о протекании мицеллярного катализа.
Список литературы:
- Великанова Л.Н., Семченко В.В., Хентов В.Я. Кинетические закономерности извлечения металлов из техногенного сырья // Журнал прикладной химии. — 2011. —Т. 84. — Вып. 9. — С. 1418—1423.
- Вережников В.Н. Организованные среды на основе коллоидных поверхностно-активных веществ. Издательско-полиграфический центр Воронежского государственного университета, 2008. — 74 с.
- Кужаров А.С., Хентов В.Я. О взаимодействии высокодисперсных переходных металлов с салицилальанилином // Координационная химия. — 1979. — № 4. — С. 601.
- Семченко В.В., Великанова Л.Н., Хентов В.Я. Влияние природы растворителя на кинетику донорно-акцепторного взаимодействия меди с салицилальанилином // Известия вузов. Северо-Кавказский регион. Технические науки. — 1998. — № 2. — С. 55—58.
- Хентов В.Я., Великанова Л.Н., Кужаров А.С., Верещака В.В. Донорно-акцепторное взаимодействие меди, никеля и их труднорастворимых соединений с салицилальанилином // Интенсификация процессов переработки минерального сырья. — М.: Наука, 1981. — С. 156—159.
- Хентов В.Я., Великанова Л.Н., Семченко В.В., Слабинская А.Б. Извлечение металлов из техногенного сырья // Журнал прикладной химии. — 2007. — Т. 80. — Вып. 7. — С. 1057—1062.
- Хентов В.Я., Великанова Л.Н., Семченко В.В., Егорова Н.А. Решение проблемы рециклинга металлов на основе донорно-акцепторных систем // Экология и промышленность России. — 2009. — Март. — С. 48—49.
дипломов


Оставить комментарий