Статья опубликована в рамках: VII Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 07 февраля 2013 г.)
Наука: Медицина
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
дипломов
СОДЕРЖАНИЕ МАЛОНОВОГО ДИАЛЬДЕГИДА, ЦЕРУЛОПЛАЗМИНА И АКТИВНОСТЬ ГЛУТАТИОН-S-ТРАНСФЕРАЗЫ В ПЛАЗМЕ КРОВИ БОЛЬНЫХ С СЕРДЕЧНОСОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ
Белоусова Юлия Николаевна
Вьюшенская Татьяна Владимировна
Решетова Оксана Анатольевна
магистранты 2 курса кафедры медицинской биологии и базовой кафедры биотехнологии ИФБиБТ, СФУ, г. Красноярск
E-mail: vvuvtv@mail.ru
Шишацкая Екатерина Игоревна,
научный руководитель, д-р биол. наук, профессор кафедры медицинской биологии ИФБиБТ, СФУ, г. Красноярск
Сердечнососудистые заболевания (ССЗ) служат основной причиной заболеваемости, смертности и инвалидности у лиц трудоспособного возраста в экономически развитых странах. В связи с этим интерес к изучению этиологии и патогенеза ССЗ не ослабевает. В настоящее время показано, что усиление генерации активных форм кислорода (АФК) предшествует и способствует прогрессированию таких заболеваний как атеросклероз, ишемическая болезнь сердца, артериальная гипертензия, сахарный диабет [15]. К АФК относят супероксидный анионрадикал (O·-2), пергидроксильный радикал (НО2), гидроксильный радикал (.ОН), пероксид водорода (Н2О2) синглетный кислород (1О2) и гипохлорную кислоту (HOCl) [1,10]. Около 95-98% потребляемого организмом человека кислорода используется в процессах генерирования энергии. В АФК переходит около 2—5 % [3]. В тканях концентрация различных АФК может существенно различаться. Так, концентрация супероксида в печени — около 10-11мМ, концентрация Н2О2 примерно 10-8 мМ [6]. АФК могут проявлять выраженное токсическое действие на клетки. Они обычно появляются первыми в цепи реакций свободнорадикального окисления и дают начало серии радикалов, инициируя перекисное окисление липидов (далее — ПОЛ), что ведет к образованию пероксидных радикалов, моно- и димерных, циклических и полимерных перекисей и гидроперекисей. Конечными продуктами ПОЛ являются альдегиды, кетоны и предельные углеводороды [2]. Многие продукты ПОЛ способны оказывать негативное воздействие на клетки. В частности, ненасыщенные альдегиды являются мутагенами и обладают выраженной цитотоксичностью: подавляют активность гликолиза и окислительного фосфорилирования, ингибируют синтез белка и нуклеиновых кислот, окисляют SH-группы, ингибируют различные ферменты. Отличительной чертой ПОЛ является ее цепной, самоиндуцирующийся характер [9]. ПОЛ протекает в несколько стадий: «инициирование», «продолжение», «разветвление» и «обрыв» цепи (рис.1)
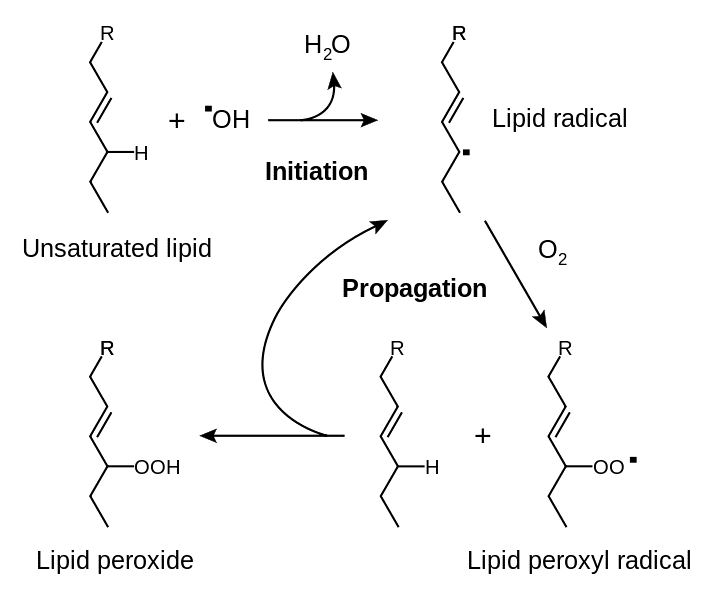
Рисунок 1. Схема перекисного окисления липидов
Одним из основных эффектов АФК является разрушение жирных кислот, являющихся компонентами клеточных мембран. В результате таких реакций происходит формирование каналов проницаемости в клеточной стенке, что нарушает жизнедеятельность клетки и приводит к ее гибели. Повреждение свободными радикалами белковых структур и молекул ДНК делает возможным развитие многих патологических состояний [8].
Мутагенное воздействие АФК может быть причиной злокачественного перерождения клеток или их апоптозной гибели. Известно, что мишенями для свободных радикалов могут быть почти все органы и системы организма.
Определение уровня продуктов окисления оказалось более информативным при установлении взаимосвязи интенсивности оксидативных процессов с клиническими проявлениями ССЗ, в частности выраженности стенокардии, аритмии. Кроме того показано, что классические факторы риска развития сосудистых заболеваний (дислипидемия, сахарный диабет) запускают процессы перекисного окисления, причем, чем больше факторов риска выявляется у пациента, тем выраженнее протекают процессы окисления. Поэтому представляется важным оценивать роль АФК в прогрессировании ССЗ. Интенсивные клинико-биохимические исследования последнего десятилетия, широко отраженные в мировой литературе, позволили выявить весьма распространенный и «типовой», почти универсальный компонент метаболических нарушений при различных сердечно- сосудистых заболеваниях: повышение уровня перекисного окисления липидов (ПОЛ). Повышение уровня ПОЛ является, с одной стороны, отражением степени, меры и глубины метаболических расстройств у конкретного больного, а с другой, накопление липоперекисей вызывает ряд серьезных вторичных патологических феноменов.
Проявлению негативного повреждающего действия свободных радикалов и перекисных соединений препятствует многокомпонентная антиоксидантная система (далее — АОС), обеспечивающая связывание и рекомбинацию радикалов, предупреждение образования или разрушение перекисей.Система антиоксидантной защиты организма в ее современном представлении состоит из двух основных звеньев: ферментативного и неферментативного. Неферментативное звено представлено водо- и жирорастворимыми веществами экзогенного или эндогенного происхождения. Функция антиоксидантных ферментов в организме заключается в поддержании стационарной концентраций перекисей и кислородных радикалов. К антиоксидантным ферментам относят: супероксиддисмутазу, каталазу, глутатионпероксидазу, глутатионтрансферазу [4].
Исключительно важным моментом эффективности ферментативного звена АОС является сбалансированность активности супероксиддисмутазы, каталазы и пероксидазы. Подавление активности одного из ферментов может привести к избыточному накоплению АФК и деструкции клеток. При различных патологических состояниях концентрация и активность ферментов АОС может меняться в различных направлениях [3, с. 16].
Помимо ферментативного звена система АОС организма включает в себя неферментативное звено, играющее не менее важное значение, и состоящее из низкомолекулярных эндогенных антиоксидантов. Существует точка зрения, что при окислительном стрессе ферментативная АОС может оказываться иногда менее эффективной по сравнению с защитным действием низкомолекулярных соединений.
К наиболее важным антиоксидантам неферментативной АОС относят глутатион, токоферолы, аскорбиновую кислоту, убихинон, тиоктовая кислота, селен, мелатонин [7].
Цель работы — определение активности фермента GST, содержания МДА и церулоплазмина в плазме крови у пациентов с ССЗ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования служила плазма крови людей с ССЗ и потенциально-здоровых людей относительно данной патологии. Всего обследовано 35 человек. Забор материала проводился утром натощак из локтевой вены. Антикоагулянтом служил гепарин. Гепаринизированную кровь центрифугировали 20 минут при 1700g. После центрифугирования убирали слой плазмы и тонкую белую лейкоцитарную пленку. Плазму отбирали отдельно и сохраняли при температуре не выше — 20°С.
Определение содержания малонового диальдегида (Ko, Godin, 1990).
В липидных системах в результате процессов перекисного окисления липидов образуется малоновый диальдегид (МДА), взаимодействие которого с 2-тиобарбитуровой кислотой приводит к образованию хромогена с максимумом поглощения в красной области видимого спектра при длине волны 532 нм.
Расчёт содержания МДА производят с учётом коэффициента молярной экстинкции образовавшегося хромогена, равного 1,56*105 М-1см-1 и выражают в мкмоль/л [13].
Определение активности глутатион-S-трансферазы (Habig et al., 1974).
Активность глутатион-S-трансферазы (GST) определяют по скорости образования глутатион-S-конъюгатов между ГSH и 1-хлор-2,4-динитробензолом (ХДНБ).

Увеличение концентрации конъюгатов в ходе реакции регистрируют спектрофотометрически при длине волны 340 нм (максимум поглощения глутатион -S- ХДНБ). Активность фермента рассчитывают, используя коэффициент миллимолярной экстинкции для GS-ХДНБ при длине волны 340 нм, равный 9,6 мМ-1*см-1, и выражают в ммолях образующихся глутатион S-конъюгатов в минуту [12].
Определение содержания церулоплазмина в плазме крови модифицированным методом Ревина (Камышников, 2000).
Принцип метода основан на окислении р-фенилендиамина при участии церулоплазмина (ЦП). Для расчёта концентрации ЦП в мг/л значение оптической плотности умножали на коэффициент пересчета 875 и получали величину [5].
 ,
,
где: D — оптическая плотность анализируемого образца.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Так видно из таблицы у пациентов наблюдается усиление процессов перекисного окисления липидов по сравнению с контролем. Было установлено достоверное возрастание концентрации МДА в плазме ( в 2 раза) пациентов С ССЗ. Одним из неблагоприятных последствий перекисного окисления липидов считают образование малонового диальдегида в результате обусловленного свободными радикалами разрыва двойных связей полиненасыщенных жирных кислот. МДА образует шиффовы основания с аминогруппами белков, выступая в качестве «сшивающего» агента. В результате сшивки образуются нерастворимые липид-белковые комплексы, называемые пигментами изнашивания [11].
Таблица 1.
Содержание церулоплазмина, малонового диальдегида и активность глутатион-S-трансферазы в плазме крови при сердечнососудистых заболеваниях
|
Исследуемыe параметры |
Контроль
|
Пациенты |
Достоверность по сравнению с контролем (Р) |
|
МДА,мкмоль/л |
1,75 ± 0,19 n = 27 |
3,57 ± 0,18 n =5 |
≤ 0,001 |
|
GST, мкмоль/ мин на мл пл |
39,18 ±1,39 n = 25 |
15,27±0,80 n =10 |
≤ 0,001
|
|
Церулоплазмин, г/л |
225,45 ± 25,34 n = 25 |
166,30±7,70 n = 10 |
≤ 0,02 |
Аактивность GST снижена по сравнению с контролем почти в 2,5 раза. Глутатион-S-трансфераза способна восстанавливать гидроперокси-группы окисленных фосфолипидов непосредственно в мембранах без их предварительного фосфолипазного гидролиза. Фермент конъюгирует с глутатионом токсичные продукты ПОЛ (малоновый диальдегид, ноненали, децинали, холестерин-б-оксид) и тем способствует их выведению из организма. Таким образом, GST является важным компонентом антиоксидантной защиты, особенно от эндогенных метаболитов, образующих при окислительном стрессе [3]. Уменьшение активности, возможно, связано с конформационными перестройками молекулы фермента, вызванными воздействием АФК, либо продуктов липоперокисдации, что может приводить к уменьшению сродства фермента к субстрату и кофактору.
Одной из основных функций церулоплазмина является нейтрализация свободных радикалов, которые освобождаются вовне макрофагами и нейтрофилами во время фагоцитоза, а также при интенсификации свободно-радикального окисления в очагах воспаления [14]. Согласно многочисленным данным литературы, при различных патологических процессах уровень ЦП в плазме крови как возрастает, так и уменьшается. В наших исследованиях у пациентов обнаружено снижение содержания церулоплазмина (в 0,7 раз).
Список литературы:
1.Артюхов В.Г. Биологические мембраны (структурная организация, функции, модификация физико-химическими агентами): Изд-во Воронежского университета. Воронеж, 2000. 296 с.
2.Барабой В.А. Механизмы стресса и перекисное окисление липидов // Успехи современной биологии. — 1991. — Т. 111, вып. 6. — С. 21—28.
3.Владимиров Ю.А. Свободные радикалы в живых системах // Итоги науки и техники. Серия Биофизика. ВИНИТИ, 1991. — Т. 29. — С. 1—252.
4.Дубинина Е.Е. Некоторые особенности функционирования ферментативной антиоксидантной защиты плазмы крови человека // Биохимия. — 1993. — Т. 58, вып. 2. — С. 268—273.
5.Камышников B.C. Справочник по клинико-биохимической лабораторной диагностике / B.C. Камышников. Минск, 2000. — С. 74—75.
6.Кулинский В.И. Активные формы кислорода и оксидативная модификация макромолекул: польза, вред и защита // Соросовский образовательный журнал. — 1999. — № 1. — С. 2—7.
7.Курашвили В.А., Майлэм Л. Новые возможности предотвращения оксидативного стресса // Журнал натуральной медицины. — 2001. — № 1. С. 7—14.
8.Ланкин В.З. Свободнорадикальные процессы в норме и при патологиях / В.З. Ланкин, А.К. Тихазе, Ю.Н. Беленков. — М.: Наука, 2001.— 185 с.
9.Менщикова Е.Б. Антиоксиданты и ингибиторы радикальных окислительных процессов // Успехи современной биологии. — 1993. — Т. 113, вып. 4. — С. 442—455.
10.Прайер У. Свободные радикалы в биологии: в 2-х т. М.: Мир, 1979. — Т. 1. 311 с.
11.Gerritsen W.B., van Boven W.-J.P., Boss D.S. et al. Malondialdehyde in plasma, a biomarker of global oxidative stress during mini-CABG compared to on- end off-pump CABG surgery: a pilot study. — Interactive Cardio Vascular and Thoractic Surgery, 2006, v. 5, p. 27—31.
12.Habig W.H. Glutathione-S-transferases. The first enzymes step mercapturic acid formation/ W.H. Habig, M.J. Pabst, W.B. Jacoby// J. Biol. Chem, 1974. —Vol. 249. -Issue 22. — P. 7130—7139.
13.Ko K.M. Ferric ion-induced lipid peroxidation in eryhtrocyte membranes: effects of phytic acid and butylated hydroxytoluene // Mol. and Cell. Biochem.- 1990.— № 10.— P. 125—131.
14.Nejfah S.A. Stroenie, kataliticheskie svojstva i jevoljucija ceruloplazmina i drugih golubyh belkov / Nejfah S.A., Vasil'ev V.B., Shavlovskij M.M. // Usp. biolog. himii. — 1989. — № 38. —S. 102—124.
15.Singal P.K., Khaper N., Palace V. et al. The role of oxidative stress in the genesis of heart disease. Cardiovasc Res 1998; 40: 426—432.
16.Stocker R., Frei B. Endogenous antioxidant defences in human blood plasma. In: Sies H. ed. Oxydative stress: oxidants and antioxydants. London: Academic Press. — 1991. — P. 121—128.
дипломов


Оставить комментарий