Статья опубликована в рамках: XIX Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 27 мая 2014 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
отправлен участнику
ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ МЕХАНИЗМА СОРБЦИИ ФЕНОЛА НА УГОЛЬНО-МИНЕРАЛЬНОМ СОРБЕНТЕ
Чухрина Виктория Вадимовна
студент 4 курса, химический факультет ФГБОУ ВПО «Астраханский Государственный Университет», РФ, г. Астрахань
E -mail: chukhrina@rambler.ru
Золотарева Наталья Валерьевна
научный руководитель, канд. техн. наук, доцент кафедры аналитической и физической химии, ФГБОУ ВПО АГУ, РФ, г. Астрахань
Алыков Нариман Мирзаевич
научный руководитель, д-р хим. наук, профессор ФГБОУ ВПО АГУ, РФ, г. Астрахань
В настоящее время общедоступным и сравнительно дешевым сырьем для получения сорбентов являются растительные отходы агропромышленного комплекса. В частности, существуют различные способы модификации поверхности сорбентов: усиление ионообменных и окислительно-восстановительных свойств, фиксация на поверхности разнополярных функциональных групп, введение в углеродную матрицу комплексообразователей, или напротив, удаление с поверхности углеродного сорбента структурообразующей матрицы оксида кремния и многое другое [2].
Возрастает интерес к природным сорбентам, используемым в настоящее время как в медицине для детоксикации биологических жидкостей, так и в промышленности для очистки сточных промышленных вод. Наибольшее распространение получили активные угли из ореховой скорлупы [1], из древесных опилок [3].
Нами была изучена адсорбционная способность угля, полученного из тростника и медицинского угля, используемого в качестве сорбента — сравнения по отношению к фенолу.
В основе количественного определения фенола лежит фотометрическое определение с использованием реакции азосочетания. В 10 пробирок ёмкостью 10 см3 вносят 0; 0,1; 0,2; 0,4; 0,6; 0,8; 1,0; 1,4; 1,6; 2,0 см3 10-3 М раствора исследуемого фенола и добавляют воду до 8 см3, по 2 см3 раствора свежеприготовленного диазосоединения и по 2,1 см3 1 % раствора гидроксида натрия, поддерживая температуру на уровне 5° С Смесь тщательно перемешивают и через 5 мин измеряют оптические плотности при λ=430 нм в кювете толщиной 0,1 см относительно воды.
Во вторую серию — в 10 пробирок ёмкостью 10 см3 вносят 0; 0,1; 0,2; 0,4; 0,6; 0,8; 1,0; 1,4; 1,6; 2,0 см3 10-3М раствора исследуемого фенола и добавляют воду до 10 см3. Добавляют по 0,2 г сорбента, встряхивают в течение 10 мин и центрифугируют в течение 15 мин при 1500 об/мин. Переливают в отдельные пробирки с добавлением 2 см3 раствора диазосоединения и по 2,1 см3 1 % раствора гидроксида натрия, поддерживая низкую температуру. Смесь тщательно перемешивают и через 5 мин. измеряют оптические плотности при λ=430 нм в кювете толщиной 0,1 см относительно воды [4].
На рис. 1 приведены статистически обработанные прямые зависимости «сорбция — равновесная концентрация» при различных температурах.

Рисунок 1. Зависимость сорбции фенола на активном угле из тростника от равновесной концентрации вещества 1 — при температуре 278 К; 2 — при температуре 300 К; 3 — при температуре 323 К
Сорбцию (Г, г/г) рассчитывали по формуле:
|
|
(1) |
где: С0 и [C] — исходная и равновесная концентрации, моль/дм3;
V = 10 см3 — объем рабочего раствора;
m — масса сорбента, г.,
М — молярная масса исследуемого соединения
Для трех температур были найдены константы сорбции, рассчитаны изменение энтальпии (DН), изобарно-изотермический потенциал (DG) и изменение энтропии (DS) сорбционного процесса.
|
|
(2) |
|
|
(3) |
|
|
(4) |
Расчет площади поверхности занимаемой молекулой фенола на сорбенте осуществляется по формуле:
|
|
(5) |
В таблице 1 приведены результаты расчетов по сорбции фенола на поверхности активного угля, полученного из тростника.
Таблица 1.
Термодинамические показатели сорбции фенола на активном угле из тростника
|
Т, К |
К·10-3 |
-DG, кДж/моль |
DS, Дж/(моль∙К) |
-DН, кДж/моль |
Г∞, г/г |
S 0·10-20 м2 |
|
300 |
2,721 |
19,71 |
172,13 |
31,93 |
1,47 |
1,03 |
|
278 |
2,008 |
17,57 |
178,06 |
1,662 |
0,969 |
|
|
323 |
13,125 |
25,45 |
177,65 |
1,000 |
1,25 |
На основании полученных результатов, можно судить о том, что процесс протекает самопроизвольно, экзотермичность процесса можно наблюдать во всем интервале температур. О полноте протекания процесса адсорбции можно судить по величине энергии Гиббса и константе адсорбции. С увеличением температуры увеличивается интенсивность адсорбционного процесса. Величина предельной адсорбции фенола из мономолекулярного слоя варьируется в результате разнородности состава поверхности угля, наличия макро- и микропор, о чем свидетельствует вид, полученных изотерм (рис. 1). Предположительно, процесс протекает с образованием водородных связей между молекулой фенола и поверхностным адсорбционным слоем угля.
Как видно из таблицы, с увеличением температуры увеличивается площадь, занимаемая одной молекулой фенола в насыщенном адсорбционном слое угля. На основании полученных данных можно судить о величине межъядерного расстояния в адсорбате. Проведенный анализ теоретических данных межъядерного расстояния молекул ОН-группы показал, что в метаноле данная характеристика составляет 0,956Å, в воде — 0,958Å, в феноле — 0,96Å. Эти данные нам понадобятся для квантово-химического моделирования сорбционного процесса. Диапазон изменения межъядерного расстояния соответствует модели взаимодействия, при которой участвует ОН группа сорбата. Параллельно нами была изучена сорбция фенола на медицинском активированном угле. Отметим, что данный сорбент полностью поглощает фенол, этот факт не позволяет установить сорбционную емкость медицинского угля.
Также нами была изучена кинетика сорбции фенола на угольном сорбенте, полученном из тростника южного. Методика предполагает приготовление нулевой пробы раствора фенола и проведение индикаторной реакции. В оставшийся раствор фенола вносят определенное количество сорбента и через определенное количество времени отбирают пробы, центрифугируют и проводят индикаторные реакции.
В колбу ёмкостью 250 см3 вносят 25 см3 раствор фенола с концентрацией 10-3 М и доводят водой до 250 см3. Далее отбирают нулевую пробу 8 см3 и проводят индикаторную реакцию, т. е. добавляют 2 см3 раствора диазосоединения и 2,1 см3 1 % раствора гидроксида натрия (поддерживая низкую температуру). Смесь тщательно перемешивают и через 5 мин. измеряют оптические плотности в кювете толщиной 1 см относительно воды при λ=430 нм. В оставшийся раствор вносят 0,5 г сорбента, включая одновременно секундомер, смесь встряхивают и отбирают пробу по 10 см3 через 5, 10, 15, 20, 40, 60 с….2, 4, 6, 12, 24, 36 мин. Растворы центрифугируют в течение 15 мин при 1500 об/мин. далее отбирают по 8 см3 и проводят индикаторную реакцию, т. е. добавляют 2 см3 раствора диазосоединения и по 2,1 см3 1 % раствора гидроксида натрия (поддерживая низкую температуру). Смесь тщательно перемешивают и через 5 мин. измеряют оптические плотности в кювете толщиной 1 см относительно воды при λ=430 нм.
На рис. 2 приведены изотермы зависимости «оптическая плотность — время» при различных температурах.

Рисунок 2. Зависимость сорбции фенола на активном угле из тростника от времени 1 — при температуре 278 К; 2 — при температуре 323 К; 3 — при температуре 300 К
По экспериментальным данным, с использованием кинетического уравнения первого порядка, по уравнению рассчитываем значения констант скоростей сорбции:
|
|
(6) |
где: τ — время, мин;
А 0 — исходные оптические плотности (при τ = 0);
Ai — оптические плотности, соответствующие τi.
Термодинамические характеристики определяли по формулам:
|
|
(7) |
|
|
8) |
|
|
(9) |
В табл. 2 представлены термодинамические характеристики кинетики сорбции фенола при трех температурах.
Таблица 2.
Термодинамические характеристики
|
Т, К |
ln pZ0 |
-DG#, кДж/моль |
-DS#, Дж/моль×К |
DЕакт, кДж/моль |
|
278 |
2,32 |
31,606 |
113,58 |
32,14 |
|
300 |
34,05 |
114,15 |
||
|
323 |
37,12 |
114,82 |
На основании полученных данных, можно судить о механизме протекания реакции, поскольку энергия активации составляет 32,14 кДж/моль (при исследовании термодинамики сорбционного процесса -ΔH =31,93 кДж/моль), это свидетельствует об образовании многочастичных водородных связей. Низкие значения энтропии свидетельствуют о том, что взаимодействие молекул фенола с приповерхностным гидратированным слоем сорбента происходит при определенном расположении молекул адсорбата.
В результате проделанной работы, можно сказать, что активный уголь, полученный при термической обработке тростника Южного (Phragmites australis), является достаточно перспективным материалом для сорбирования молекул фенола, с целью очистки вод от его молекул.
Список литературы:
1.Активированный уголь, импрегнированный кислотой, способы его получения и применения: пат. 2463107 РФ: МПК B01J20/32/ Джонсон Ридард Л., Кузуб Р. Юджин, Так Дзтн Квон; патентообладатель: Карбон Солюшнз инк.; № 2009110159/05; заявл. 23.08.07; опубл. 10.10.12.
2.Манастырлиу М.А., Кириленко Т.В., Иоргова А.С. Адсорбционные свойства модифицированных фитосорбентов на основе ячменной соломы // Нано – и супрамолекулярная химия в сорбционных и ионообменных процессах: Материалы Международной молодежной конференции. Казань: КНИТУ, 2011 г.
3.Углеродный сорбент и способ его получения: пат.2064429 РФ: МПК6 С01В31/08/ Стрелко В.В., Картель Н.Т., Пузий А.М., Чихман Ю.П., Титаренко В.Н.; № 5048006/26; заявл. 09.04.92; опубл. 27.07.96.
4.Чухрина В.В., Золотарева Н.В. Сорбционное концентрирование фенола природным угольными сорбентами. Фундаментальные и прикладные проблемы получения новых материалов: исследования, инновации и технологии. Материалы VII международной научно-практической конференции для молодых ученых 23—25 апреля 2013 г., стр. 88, 2013 г.
отправлен участнику




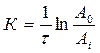
Оставить комментарий