Статья опубликована в рамках: XXX Международной научно-практической конференции «Научное сообщество студентов XXI столетия. ЕСТЕСТВЕННЫЕ НАУКИ» (Россия, г. Новосибирск, 07 апреля 2015 г.)
Наука: Химия
Скачать книгу(-и): Сборник статей конференции
- Условия публикаций
- Все статьи конференции
отправлен участнику
РОЛЬ СОРБЦИОННЫХ ВЗАИМОДЕЙСТВИЙ ФЕРМЕНТ-СИЛИКАГЕЛЬ В ПРОЦЕССЕ ПОЛУЧЕНИЯ ПЕРОКСИДАЗНЫХ КАТАЛИЗАТОРОВ
Аралкин Олег Леонидович
студент 3 курса, кафедра общей и физической химии, Таврическая академия КФУ им. В.И. Вернадского, РФ, г. Симферополь
Е-mail : kd-1994@mail.ru
Биба Мария Владимировна
студент 3 курса, кафедра общей и физической химии, Таврическая академия КФУ им. В.И. Вернадского, РФ, г. Симферополь
Кунык Анастасия Николаевна
магистрант 1 курса, кафедра общей и физической химии, Таврическая академия КФУ им. В.И. Вернадского, РФ, г. Симферополь
Е-mail: nastyusha 2102@mail.ru
Вяткина Оксана Валерьевна
научный руководитель, канд. хим. наук, доцент, Таврическая академия КФУ им. В.И. Вернадского, РФ, г. Симферополь
Введение
Нативные ферменты — биокатализаторы белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям и колебаниям рН среды [6, с. 27—29]. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Природа подложек для иммобилизации может быть весьма разнообразной [5]. Особое место среди минеральных носителей занимает силикагель. Важнейшим преимуществом силикагеля по сравнению с природными пористыми материалами является возможность изменения его структуры в процессе формирования [1, с. 498—506]. Известно, что силикагели, синтезированные при кислых рН, отличаются небольшим размером глобул, малым объемом пор и большой удельной поверхностью, в то время как силикагели, синтезированные при щелочных рН имеют большой размер глобул, большой объем пор и малую удельную поверхность [9]. Химическая инертность, высокая термостойкость, лёгкость регулирования пористой структуры делает возможным приготовление на основе силикагеля ферментных катализаторов, среди которых широкое применение в медицине, экологическом мониторинге и водоочистке имеют материалы с пероксидазной активностью [3; 8].
Поэтому целью нашей работы было изучение сорбционных свойств силикагелей, синтезированных при различных рН, а также возможности их использования в качестве подложки для иммобилизации пероксидазы редьки черной.
Материалы и методы исследования
Исследования проводили с фосфатно-буферным экстрактом (рН=7) пероксидазы, выделенной из корнеплода редьки черной по стандартной методике [7, с. 144—147, 161]. В качестве подложки для иммобилизации использовали силикагели, синтезированные из силикатного клея (жидкого стекла) при различных рН. Гели кремниевой кислоты при рН<2 и рН=10 получали при взаимодействии силикатного клея, разведенного 1:1 дистиллированной водой с раствором 6М HCl, который добавляли по каплям при постоянном перемешивании до соответствующего рН системы.
Образование геля кремниевой кислоты описывается уравнением:
xNa 2SiO3 + 2xHCl + (y-x)H2O = 2xNaCl + xSiO2 ·yH2O (1)
Для получения геля кремниевой кислоты при рН=7 в качестве осадителя использовали 2,5 М раствор NH4Cl. При воздействии хлорида аммония на кремнезем-содержащий материал сначала происходит гидролиз NH4Cl:
NH4Cl + H2O = NH4OH + HCl, (2)
а затем образуется гель по уравнению (1).
Образовавшийся осадок кремниевой кислоты промывали дистиллированной водой до удаления хлорид-ионов. Промытые гели поликремниевой кислоты высушивали при температуре 150 0С и помещали в герметичные пластиковые пакеты. У синтезированных силикагелей определяли количество активных гидроксилов на поверхности методом потенциометрического титрования 0,1 N растворами NaOH и HCl.
Сорбцию пероксидазы из фосфатно-буферных экстрактов на силикагеле изучали в статических условиях в системах с объёмными концентрациями экстракта от 5 до 80 %, при температуре 25 °С. Время экспозиции варьировали от 20 до 90 мин. Концентрацию фермента контролировали фотоколориметрически при λ=400 нм. Для выявления характера сорбции строили графики в координатах ΔD=Dнач-Dкон, где Dнач и Dкон оптические плотности растворов пероксидазы до и после сорбции.
Количество сорбированного фермента характеризовали разностью оптических плотностей растворов адсорбтива до и после сорбции. После чего рассчитывали степень связывания фермента с твёрдой фазой N (1).
N (%) = ;
;
где: N (%) — степень связывания фермента на силикагеле,
Dнач., Dкон.— начальная и конечная оптические плотности ферментсодержащего раствора, соответствующие объемным концентрациям пероксидазы в системе, соответственно. Десорбцию фермента с силикагеля в дистиллированную воду изучали в системах аналогичных сорбционным в течение 10 минут и 24 часов.
Иммобилизацию пероксидазы на силикагель проводили методом сорбции из фосфатно-буферных растворов в статических условиях при температуре 25 °С, при этом использовали растворы с объёмными концентрациями фермента от 20 до 70 %.
Активность ферментных препаратов определяли по начальной скорости окисления субстрата восстановителя. Изменение концентрации гидрохинона контролировали фотоколориметрическим методом по реакции с о-фенантролином в присутствии ионов Fe3+ (λ=580 нм) [4, с. 370]. За единицу молярной активности приняли количество окисленного субстрата (мкМ), катализированного 1 мл ферментного препарата на протяжении 1 минуты.
Ам (активность)= ![]() ;
;
1·![]() =1е.а.
=1е.а.
Также рассчитывали удельную активность:
Ау (активность)= ![]() ;
;
1·![]() =1е.а.
=1е.а.
Результаты исследования
Результаты определения количества активных силанольных групп и других сорбционных центров на поверхности силикагелей синтезированных при различных рН представлены в табл. 1.
Таблица 1.
Количество активных ОН-групп на поверхности силикагелей, синтезированных в при различных рН
|
|
рН синтеза силикагеля |
||
|
|
< 2 |
7 |
10 |
|
n(-ОН), ммоль-экв/г |
n(-ОН), ммоль-экв/г |
||
|
потенциометрическое титрование NaOH |
0,10±0,007
|
0,12±0,003
|
0,26±0,004
|
|
потенциометрическое титрование HСl |
0,06±0,002
|
0,30±0,007
|
0,50±0,004
|
|
Литературные данные [9, стр. 86] |
|||
|
объем пор Vп, см3/г |
0,5-0,3 |
0,8-0,5 |
|
|
удельная поверхность Sуд, м2/г |
800-650 |
450-250 |
|
Анализ экспериментальных данных показывает, что количественные характеристики титрования отличаются для силикагелей в зависимости от условий их получения. Из таблицы видно, что у силикагелей, синтезированных в нейтральной среде, количество основных центров на поверхности в 2,5 раза превышает количество кислотных центров, что подтверждается смещением водородного показателя 5 % водных суспензий силикагеля в щелочную область (рН= 8,6—8,8), тогда как рН дисперсионной среды нейтрально. Суммарное количество активных кислотно-основных центров на поверхности исследуемого силикагеля составило 0,42 ммоль-экв/г, что больше чем у кислого силикагеля (n(-ОН)=0,16, ммоль-экв/г), но меньше чем у щелочного (n(-ОН)=0,76, ммоль-экв/г).
Сравнение с ранее полученными данными, представленными в таблице 1 показало, что при синтезе силикагеля в нейтральной и щелочной среде значительно увеличивается количество как основных так и кислотных гидроксилов на поверхности по сравнению с кислотными силикагелями, не смотря на укрупнение частиц и уменьшение удельной площади поверхности, Это объясняется тем, что силикагели содержат некоторое количество ионов натрия и аммония в структуре (после отмывки от солей), в основном в приповерхностной области. Тщательная водная отмывка способствует замене NH4+ и Na+ на Н+ и образованию внутриглобулярных групп Si-O-Н+.
Было также отмечено, что в литературе упоминается об уменьшении объёма пор и удельной площади поверхности силикагеля при рН синтеза больше 7. Однако, количество активных гидроксилов на поверхности таких материалов больше чем у силикагелей, синтезированных при рН 6-7, возможно за счёт того, что большая часть силикатных олигомеров, участвующих в формировании каркаса, расположена на поверхности глобул торцом и имеет свободные гидроксилы. При более низких рН синтеза олигомеры располагаются преимущественно плашмя на глобулах, при этом их гидроксилы связаны с поверхностью глобул [9, с. 82—84]. Таким образом, было установлено, что силикагели, синтезированные в нейтральной среде, имеют большее количество сорбционных центров на поверхности по сравнению с кислотными силикагелями. Этот факт, наряду с информацией о большем диаметре пор таких материалов по сравнению с щелочными силикагелями и оптимальными для работы фермента рН водных суспензий, позволяет предположить перспективность использования данных материалов в качестве подложки для иммобилизации пероксидазы редьки черной.
Результаты, полученные при исследовании динамики процессов сорбции пероксидазы из фосфатно-буферных растворов с объёмной концентрацией фермента 20 % на исследуемых подложках показали, что в случае с материалами, полученными при рН=7 и рН=10, уже через 60 минут, а в случае силикагеля с рН синтеза < 2 через 180 минут, наблюдалось резкое увеличение оптической плотности ферментно-буферного раствора при определении остаточных концентраций пероксидазы. Вероятно, это связано с образованием новых продуктов в системе вследствие взаимодействия на свету компонентов фосфатно-буферных растворов между собой, с компонентами подложки, кислородом воздуха. Одними из таких продуктов могут быть сополимеры пероксидазы, включающие в себя от 2 до 10 молекул фермента. Из литературных источников известно, что образование таких сополимеров ведет к понижению каталитической активности пероксидазы [2]. Также было установлено, что максимальные степени связывания фермента с подложкой в случае силикагеля с рН синтеза 7 достигаются через 30 минут; для силикагеля с рН синтеза 10 через 60 мин, а для силикагеля, полученного при рН < 2 через 120 мин (рис. 1, 2,3).

Рисунок 1. Степень связывания (N %) пероксидазы редьки черной на силикагеле (рНсинтеза=7) (τ=30 мин)

Рисунок 2. Степень связывания (N %) пероксидазы редьки черной на силикагеле (рНсинтеза<2) (τ=120 мин)

Рисунок 3. Степень связывания (N %) пероксидазы редьки черной на силикагеле (рНсинтеза=10) (τ=60 мин)
Сравнение изотерм сорбции пероксидазы редьки черной на силикагелях, синтезированных при различных рН представлены на рис. 4. Все они имеют вид характерный для полимолекулярной сорбции, которая реализуется при связывании полиэлектролитов белковой природы на минеральных подложках.
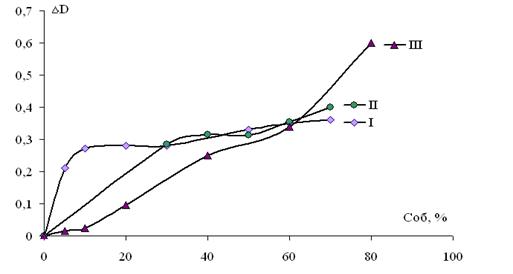
Рисунок 4 . Влияние рН синтеза силикагелевой подложки на механизм сорбции из фосфатно-буферних растворов пероксидазы редьки черной. I — рН синтеза силикагеля < 2; II — рН синтеза силикагеля 10; III — рН синтеза силикагеля 7
Как видно из рисунка, независимо от времени контакта, фермент — подложка, синтезированная в щелочной среде. Формирование монослоя адсорбата происходит в диапазоне объёмных концентраций фермента в растворе от 40 % до 50 %. Тогда как на кислых силикагелях в диапазоне 10—30 %. Это, очевидно, связано с сорбцией молекул пероксидазы не только на поверхности щелочного силикагеля, но и в порах соизмеримых с молекулярными размерами фермента. Изотерма сорбции пероксидазы на силикагеле, синтезированном нейтральной среде (рис. 4, III) вообще не имеет явно выраженной области формирования монослоя, но точка перегиба соответствующего началу формирования полимерной сетки адсорбата на поверхности подложки соответствует 40% объёмной концентрации фермента.
Результаты изучения обратимости сорбции пероксидазы редьки черной на силикагеле (рНсинтеза=7) показали, что уже в течение первых 10 мин экспозиции ферментного препарата в дистиллированной воде, в области низких концентраций фермента, сорбция полностью обратима. В диапазоне объёмных концентраций фермента, соответствующих формировании поли-слоёв на поверхности подложки (от 40 % до 80 %), десорбция составляет не менее 95 %. Таким образом, в течение первых 10 минут практически весь фермент переходит с силикагеля в водную фазу системы и дальнейшее его действие подобно нативной пероксидазе, что подтверждается высоким поглощением растворов, после 24 часов экспозиции, связанным опять же с образование неактивных окрашенных продуктов сополимеризации пероксидазы. Также было установлено, что в случае щелочных силикагелей после выдерживания полученного препарата в дистиллированной воде, в течении 10 минут, десорбция отсутствует, а 24 часовая экспозиция в дистиллированной воде иммобилизованного на силикагеле фермента показала десорбцию не более 10 % фермента, тогда как с кислого силикагеля в аналогичных условиях десорбируется 70 %.
Как правило, формирование полимолекулярных слоёв фермента на поверхности подложек ведёт к уменьшению активности полученных препаратов. Для подтверждения данного факта, мы исследовали активность ферментного препарата, изготовленного таким образом, чтобы в результате сорбции 1г силикагеля содержал такое же количество пероксидазы как и 4 мл нативного фосфатно-буферного экстракта. Для силикагелей Результаты опыта представлены в (табл. 2).
Таблица 2.
Сравнительная характеристика ферментативной активности пероксидази редьки черной, нативной и иммобилизованной на силикагелях с разными рН синтеза. (количество пероксидазы на 1 г силикагеля эквивалентно 4 мл нативного экстракта)
|
Пероксидаза |
|
||||||
|
Нативная |
Иммобилизованная |
|
|||||
|
(pHсинтеза < 2) |
(pHсинтеза = 10) |
(pHсинтеза = 7) |
|
||||
|
Средняя удельная активность, е.а. |
|
||||||
|
____ |
0,8±0,02 |
2,7±0,2 |
1,7±0,2 |
|
|||
|
Средняя молярная активность, е.а. |
|
||||||
|
0,1±0,01 |
0,2±0,02 |
0,7±0,01 |
0,3±0,01 |
||||
Для установления оптимальных условий иммобилизации пероксидазы на силикагелях, с различными рН синтеза, мы при комнатной температуре, в течение ранее определенных периодов экспозиции сорбционных систем, характеризующихся максимальными степенями связывания фермента, проводили сорбцию фермента из 20 %, 40 %, 60 % и 70 % растворов. Результаты определения пероксидазной активности полученных препаратов представлены в таблице 3.
Таким образом, эксперимент показал, что наибольшей активностью обладают препараты полученный сорбцией пероксидазы из растворов, где не происходит образование поли — слоёв адсорбата на поверхности.
Таблица 3.
Сравнительная характеристика ферментативной активности пероксидазы редьки черной, нативной и иммобилизованной на силикагелях с разными рН синтеза в оптимальных условиях
|
пероксидаза |
|
|||
|
нативная |
Иммобилизованная |
|
||
|
(pHсинтеза < 2) |
(pHсинтеза = 10) |
(pHсинтеза = 7) |
|
|
|
Объемная концентрация ферментного препарата в растворе С, %. |
Объемная концентрация ферментного препарата в растворе при иммобилизации С,%. |
|
||
|
20 |
20 |
40 |
20 |
|
|
Средняя ферментативная активность, В е.а. |
|
|||
|
0,1±0,01 |
0,2±0,02 |
10,6±0,2 |
1,7±0,1 |
|
Выводы:
1. Установлено, что сорбция пероксидазы редьки черной на силикагелях, которые получали при разных рН отличаются по количественным параметрам и механизмам, что обусловлено структурными различиями подложек и разницей в количестве сорбционных центров на их поверхности.
2. Формирование полимолекулярных слоёв фермента на поверхности подложек ведёт к уменьшению активности полученных препаратов.
3. Оптимальным условием иммобилизации пероксидазы редьки черной на силикагеле с рН синтеза 7 при t=25 °С является её сорбция из 20 % фосфатно-буферного раствора в течение 30 минут; на силикагеле с рН синтеза 10 — сорбция из 40 % фосфатно-буферного раствора в течение 60 минут; на силикагеле с рН синтеза < 2 — сорбция из 20 % фосфатно-буферного раствора в течение 120 минут.
Список литературы:
1.Айлер Р. Химия кремнезёмов. / Р. Айлер. М.: Мир, 1982. — 712 с.
2.Александрова Е.Ю. Изучение пероксидазной активности в экстрактах из корневища и корней хрена и ее стабильности к различным воздействиям / Е.Ю. Александрова, М.А. Орлова, П.Л. Нейман // Вестник Московского университета. — 2006. — Т. 47, — № 5. — С. 350—352.
3.Алпеева И.С. Анионные пероксидазы и их применение в биоанализе: Автореферат. дис. канд. хим. наук: 02.00.15, 03.00.23 / И.С. Алпеева. М., 2007. — 28 с.
4.Лурье Ю.Ю. Химический анализ производственных сточных вод / Ю.Ю. Лурье, А.И. Рыбников. М.: Химия, 1974. — 395 с.
5.Березин И.В. Иммобилизованные ферменты / И.В. Березин, Н.Л. Клячко, А.В. Левашов. М.: Высш. шк., 1987. — 159 c.
6.Диксон М. Ферменты // М. Диксон, Э. Уэбб; пер. с англ. М.: Мир, 1982. — 515 с.
7.Селибер Г.Л. Большой практикум по микробиологии / Г.Л. Селибер. М.: Мир, 1962. — 492 с.
8.Филиппов В.Н. Комплексная очистка высококонцентрированных стоков, содержащих нефтепродукты, ПАВ и фенолы: Автореферат. дис. канд. техн. наук: 03.00.23 / УГИТУ. Уфа, 2000. — 21 с.
9.Чукин Г.Д. Химия поверхности и строение дисперсного кремнезёма / Г.Д. Чукин. М.: Типография Паладин, ООО «Принта», 2008. — 172 с.
отправлен участнику


Оставить комментарий